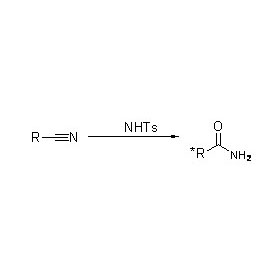
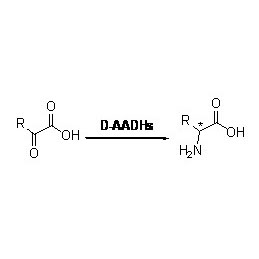
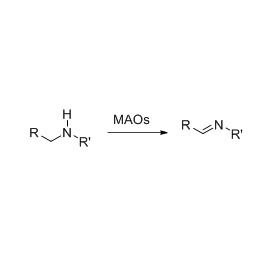
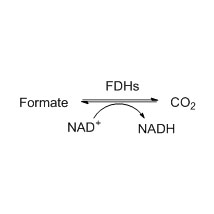
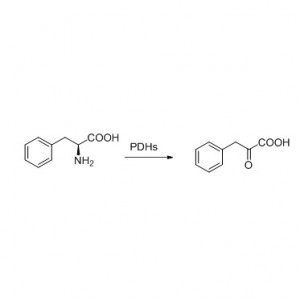
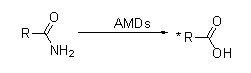
Amidase (AMD)
Enzymen:Binne makromolekulêre biologyske katalysatoren, de measte enzymen binne aaiwiten
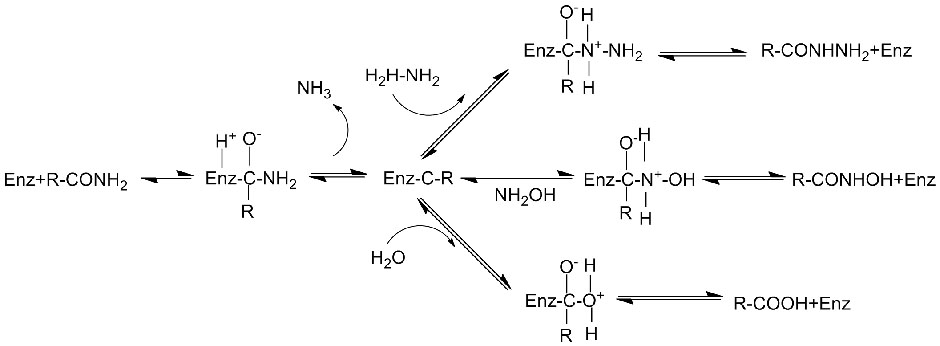
Amidase:Katalysearje de hydrolyse fan ferskate endogene en frjemde alifatyske en aromaatyske amiden troch in acylgroep oer te bringen nei wetter mei de produksje fan frije soeren en ammoniak.Hydroxamyske soeren en oare organyske soeren wurde in protte brûkt as medisinen, om't se komponinten binne fan groeifaktoaren, antibiotika en tumorinhibitoren.De amidases kinne wurde ferdield yn R-type en S-type acylases neffens de stereoselektiviteit fan 'e katalysator.
Njonken it katalysearjen fan de hydrolyse fan amiden, kin amidase ek acylferfierreaksjes katalysearje yn 'e oanwêzigens fan ko-substraten lykas hydroxylamine.
Amidase mei ferskate boarnen hawwe ferskillende substraat spesifisiteit, guon fan harren kinne allinnich hydrolyze aromaatyske amiden, guon fan harren kinne allinnich hydrolyze alifatyske amide, en guon hydrolyze α-of ω-amino amide.De measte aminen hawwe in goede katalytyske aktiviteit allinnich foar acyclyske of ienfâldige aromaatyske amiden, mar foar komplekse aromaten binne heterosyklyske amiden, benammen amiden mei orto-substituenten, oer it generaal leech yn aktiviteit (mar in pear enzymen fertoane bettere katalytyske effekten).
Katalytyske meganisme:
| Enzymen | Produkt koade | Produkt koade |
| Enzym poeder | ES-AMD-101~ ES-AMD-119 | in set fan 19 amidasen, 50 mg elk 19 items * 50mg / item, of oare kwantiteit |
| Screening Kit (SynKit) | ES-AMD-1900 | in set fan 19 amidases, 1 mg elk 19 items * 1mg / item |
★ Hege substraat spesifisiteit.
★ Sterke chirale selektiviteit.
★ Hege konverzje effisjinsje.
★ Minder byprodukten.
★ Mild reaksje betingsten.
★ Miljeufreonlik.
➢ Enzymscreening moat wurde útfierd foar spesifike substraten fanwegen de substraatspesifisiteit, en krije in enzyme dat it doelsubstraat katalysearret mei it bêste katalytyske effekt.
➢ Nea kontakt mei ekstreme omstannichheden lykas: hege temperatuer, hege/lege pH en organysk oplosmiddel mei hege konsintraasje.
➢ Normaal, it reaksje systeem moat befetsje substraat, buffer oplossing (De optimale reaksje pH fan enzyme).Co-substraten lykas hydroxylamine moatte oanwêzich wêze yn acyl oerdracht reaksje systeem.
➢ AMD moat as lêste tafoege wurde yn reaksjesysteem mei optimale reaksje pH en temperatuer.
➢ Alle soarten AMD hawwe ferskate optimale reaksjebetingsten, dus elk fan har moat yndividueel fierder bestudearre wurde.
Foarbyld 1(1):
Hydrolyseaktiviteit nei ferskate amidesubstraten
| Substraat | Spesifike aktiviteit μmol min-1mg-1 | Substraat | Spesifike aktiviteit μmol min-1mg-1 |
| Acetamide | 3.8 | ο-OH benzamide | 1.4 |
| Propionamide | 3.9 | p-OH benzamide | 1.2 |
| Lactamide | 12.8 | ο-NH2benzamide | 1.0 |
| Butyramide | 11.9 | p-NH2benzamide | 0.8 |
| Isobutyramide | 26.2 | ο- Toluamide | 0.3 |
| Pentanamide | 22.0 | p- Toluamide | 8.1 |
| Heksanamide | 6.4 | Nikotinamide | 1.7 |
| Cyclohexanamide | 19.5 | Isonicotinamide | 1.8 |
| Acrylamide | 10.2 | Picolinamide | 2.1 |
| Metacrylamide | 3.5 | 3-Fenylpropionamide | 7.6 |
| Prolinamide | 3.4 | Indol-3-acetamide | 1.9 |
| Benzamide | 6.8 |
De reaksje waard útfierd yn 50mM natriumfosfaatbufferoplossing, pH 7.5, by 70 ℃.
| Amides | Hydroxylamine | Hydrazine |
| Acetamide | 8.4 | 1.4 |
| Propionamide | 18.4 | 3.0 |
| Isobutyramide | 25.0 | 22.7 |
| Benzamide | 9.2 | 6.1 |
De reaksje waard útfierd yn 50mM natriumfosfaatbufferoplossing, pH 7.5, by 70 ℃.
Related reagent konsintraasje: amides, 100 mM (benzamide, 10 mM);hydroxylamine en hydrazine, 400 mM;enzyme 0,9 μM.
Foarbyld 2(2):
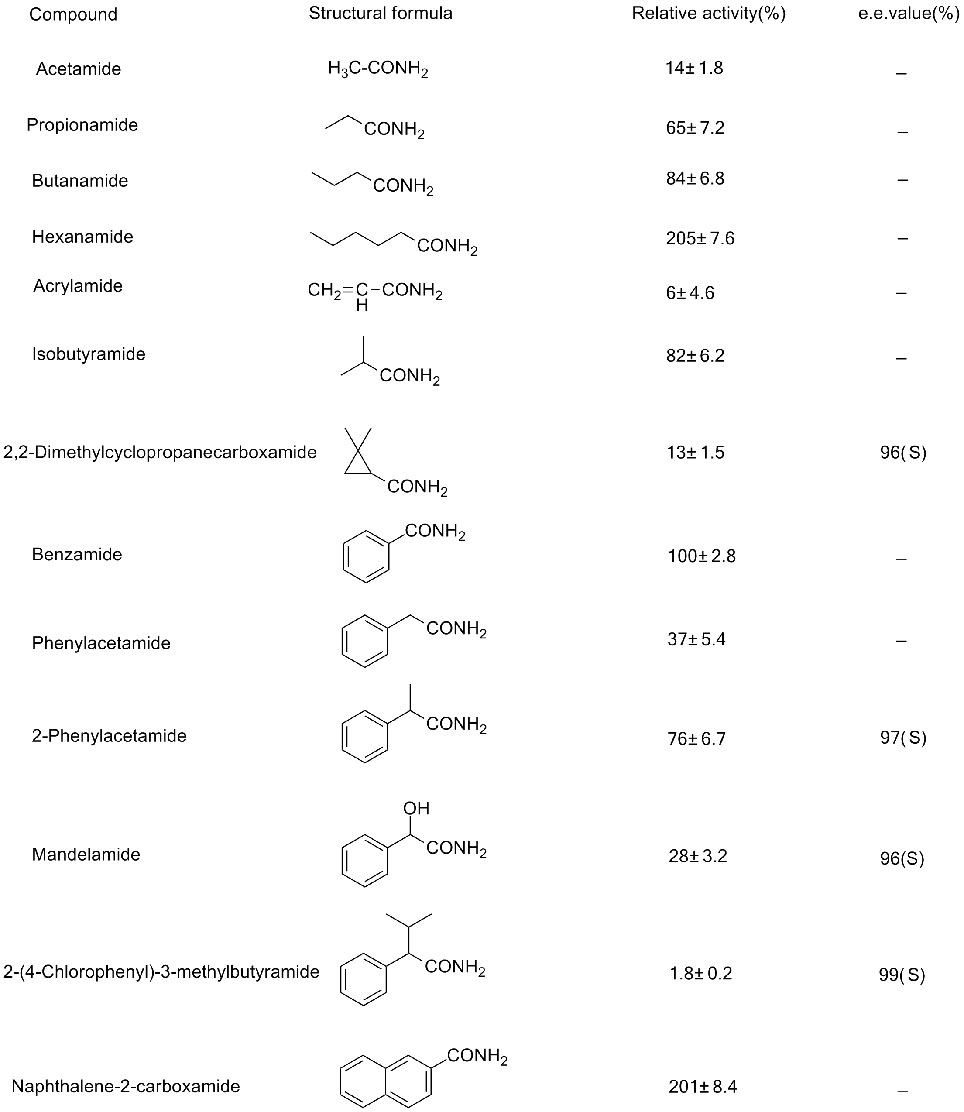
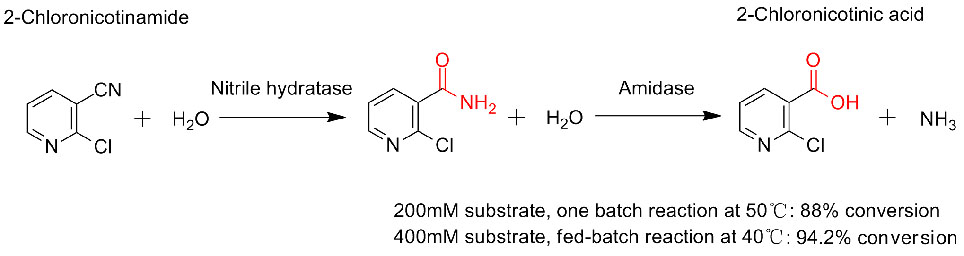
Foarbyld 3(3):
1. D'Abusco AS, Ammendola S., et al.Extremophiles, 2001, 5:183-192.
2. Guo FM, Wu JP, Yang LR, et al.Process Biochemistry, 2015, 50 (8): 1400-1404.
3. Zheng RC, Jin JQ, Wu ZM, et al.Bioorganic Chemistry, 2017, online beskikber 7.